

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Bonding in bis(cyclopentadienyl)metal complexes
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
ص561-562
2025-10-04
69
Bonding in bis(cyclopentadienyl)metal complexes
Key points: The MO picture of bonding in bis (Cp) metal complexes shows that the frontier orbitals are neither strongly bonding nor strongly antibonding; thus, complexes that do not obey the 18-electron rule are possible. We start by looking at ferrocene, where, although details of the bonding are not settled, the molecular orbital energy level diagram shown in Fig. 22.13 accounts for a number of experimental observations. This diagram refers to the eclipsed (D5h) form of the complex which, in the gas phase, is about 4 kJ mol 1 lower in energy than the staggered conform ation (Section 22.19c). We shall focus our attention on the frontier orbitals. As shown in Fig. 22.13, the e1 symmetry-adapted linear combinations of ligand orbitals have the same
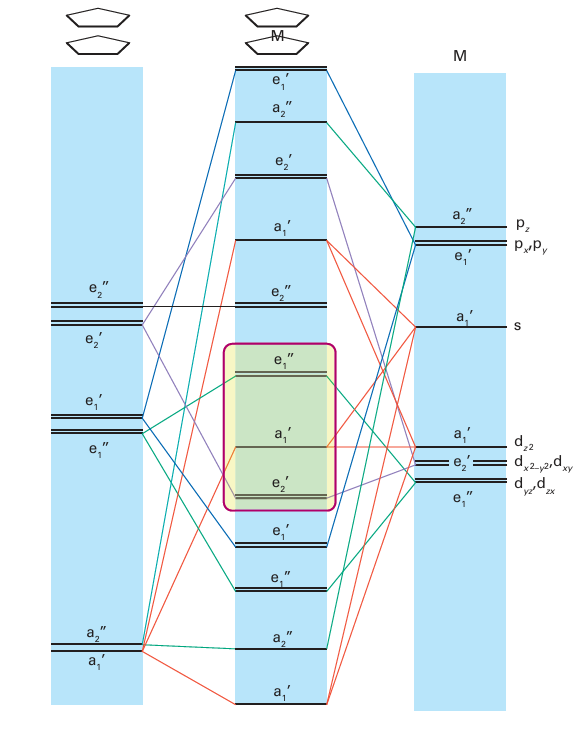
Figure 22.13 Molecular orbital energy diagram for a M(Cp)2 with D5h symmetry. The energies of the symmetry-adapted π orbitals of the C5H5 ligands are shown on the left, relevant d orbitals of the metal are on the right, and the resulting molecular orbital energies are in the centre. Eighteen electrons can be accommodated by filling the molecular orbitals up to and including the a1’ orbital in the box. The box denotes the orbitals typically regarded as frontier orbitals in these molecules.
symmetry as the dzx and dyz orbitals of the metal atom. The lower energy frontier orbital (a1) is composed of dz2 and the corresponding SALC of ligand orbitals. However, there is little interaction between the ligands and the metal orbitals because the ligand π orbitals happen to lie, by accident, in the conical nodal surface of dz2 orbital of the metal atom. In ferrocene and the other 18-electron bis(cyclopentadienyl) complexes, the a1 frontier orbital and all lower orbitals are full but the e1 frontier orbital and all higher orbitals are empty. The frontier orbitals are neither strongly bonding nor strongly antibonding. This characteristic permits the possibility of the existence of bis(cyclopentadienyl) complexes that diverge from the 18-electron rule, such as the 17-electron complex [Fe(5-Cp)2] and the 20-electron complex [Ni( 5-Cp)2]. Deviations from the 18-electron rule, however, do lead to significant changes in MC bond lengths that correlate fairly well with the molecular orbital scheme (Table 22.8). Similarly, the redox properties of the complexes can be under stood in terms of the electronic structure. We have already mentioned that ferrocene is fairly readily oxidized to the ferrociniumion, [Fe( 5-Cp)2 ] . From an orbital viewpoint, this oxidation corresponds to the removal of an electron from the nonbonding a1 orbital. The 19-electron complex [Co(5-Cp)2] is much more readily oxidized than ferrocene because the electron is lost from the antibonding e1 orbital to give the 18-electron [Co(5-Cp)2] ion. A useful comparison can be made with ocatahedral complexes. The e1 frontier orbital of a metallocene is the analogue of the eg orbital in an octahedral complex, and the a1 orbital plus the e2 pair of orbitals are analogous to the t2g orbitals of an octahedral complex. This formal similarity extends to the existence of high- and low-spin bis(cyclopentadienyl) complexes.

 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















