

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Homoleptic carbonyls
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
ص553-554
2025-10-02
124
Homoleptic carbonyls
Key points: The carbonyls of the Period 4 elements of Groups 6 to 10 obey the 18-electron rule; they have alternately one and two metal atoms and a decreasing number of CO ligands. Ahomoleptic complex is a complex with only one kind of ligand. Simple homoleptic metal carbonyls can be prepared for most of the d metals, but those of Pd and Pt are so unstable that they exist only at low temperatures. No simple neutral metal carbonyls are known for Cu, Ag, and Au or for the members of Group 12. The metal carbonyls are useful synthetic precursors for other organometallic compounds and are used in organic syntheses and as industrial catalysts. The 18-electron rule helps to systematize the formulas of metal carbonyls. As shown in Table 22.5, the carbonyls of the Period 4 elements of Groups 6 to 10 have alternately one and two metal atoms and a decreasing number of CO ligands. The binuclear carbo nyls are formed by elements of the odd-numbered groups, which have an odd number of valence electrons and therefore dimerize by forming metal-metal (MM) bonds (each MM bond effectively increases the electron count on the metal by 1). The decrease in the number of CO ligands from left to right across a period matches the need for fewer CO ligands to achieve 18 valence electrons. The simple vanadium carbonyl V(CO)6 is an exception as it only has 17 valence electrons and is too sterically crowded to dimerize; it is, however, readily reduced to the 18-electron V(CO)6 anion.
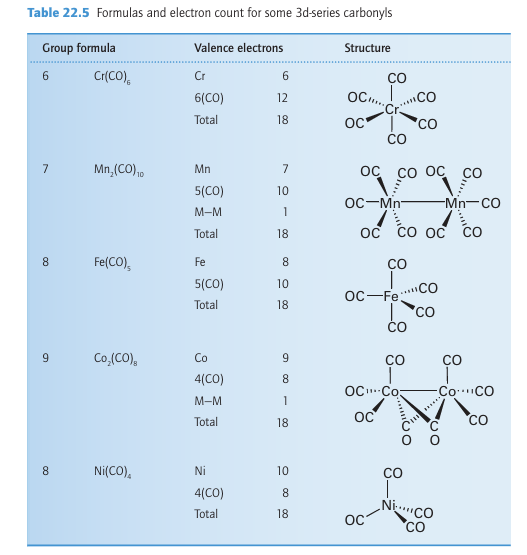
Simple metal carbonyl molecules often have well-defined, simple, symmetrical shapes that correspond to the CO ligands taking up the most distant locations, like regions of enhanced electron density in the VSEPR model. Thus, the Group 6 hexacarbonyls are octahedral, pentacarbonyl iron (0) is trigonal bipyramidal, tetracarbonyl nickel (0) is tetrahedral, and decacarbonyldimanganese (0) consists of two square-pyramidal Mn (CO)5 groups joined by a metal-metal bond. Bridging carbonyls are also found, for example one isomer of octacarbonyldicobalt (0) has its metal-metal bond bridged by two CO ligands.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















