علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Structural trends
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
458
2025-09-23
77
Structural trends
Key points: The 4d- and 5d-series elements often exhibit higher coordination numbers than their 3d-series congeners; compounds of d-metals in high oxidation states tend to have covalent structures.
We might expect the ionic radii of d-metal ions to follow the same pattern as atomic radii and decrease across each period. However, in addition to this general trend, there are some subtle effects on the size of the ions caused by the order in which. Figure 19.6 shows the variation in radius of the M2 ions for six-coordinate complexes of the 3d-series metals. To understand the two trends shown in the illustration we need to know that three of the 3d orbitals point between the ligands and that the remaining two point directly at them (this feature is explained more fully in Section 20.1). For the so-called ‘low-spin complexes’, in which electrons first individually occupy the three 3d orbitals that point between the ligands, there is a general decrease in radius across the series up to the d6 ion Fe2+. After Fe2+, the additional electrons occupy the two d orbitals that point towards the ligands, which they repel slightly and thus result in an effective increase in radius. The trend for the so-called ‘high-spin complexes’, in which the electrons occupy all five 3d orbitals singly before pairing with any already present, is more complicated. Initially, at Ti2+ (d2) and V2+ (d3), the electrons occupy the three 3d orbitals that point between the ligands and the radius decreases. The next two electrons occupy the two orbitals that point at the ligands, and the radii increase accordingly. Then the sequence starts again at Fe2 (d6), as the additional electrons pair with those already present, first in the ‘non-repelling’ set of three orbitals and then, finally, in the two ‘repelling’ orbitals.
As might be anticipated from consideration of atomic and ionic radii, the 4d- and 5d series elements often have higher coordination numbers than their smaller 3d-series co geners. Table 19.4 illustrates this trend for the fluorido and cyanido complexes of the early d metals. Note that with the small F ligand, these 3d-series metals tend to form six coordinate complexes but that the larger 4d- and 5d-series metals in the same oxidation state tend to form seven-, eight-, and nine-coordinate complexes. The octacyanidomoly- bdate complex, [Mo(CN)8]3- , illustrates the tendency towards high coordination numbers with compact ligands. The same complex is readily reduced electrochemically or chemically without change of coordination number:
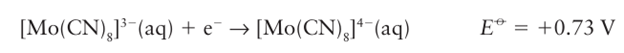
Structural changes also result from changes in metal oxidation state. Compounds of d metals in low oxidation states often exist as ionic solids, whereas compounds of d metals in high oxidation states tend to take on covalent character: compare OsO2 , which is an ionic solid with the rutile structure, and OsO4 , which is a covalent molecular species (Section 19.8). We discussed the effect in Section 1.9e.

 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)