

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
High oxidation states
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
ص453-454
2025-09-23
83
High oxidation states
Key point: The group oxidation state can be achieved by elements that lie towards the left of the d block but not by elements on the right. Oxygen is usually more effective than fluorine at bringing out the highest oxidation states because less crowding is involved. The group oxidation state (in which the oxidation number is equal to the Group number) can be achieved by elements that lie towards the left of the d block but not by elements on the right (Section 9.5). For example, Sc, Y, and La in Group 3, with configurations nd1(n+1)s2, are found in aqueous solution only in oxidation state 3, which corresponds to the loss of all their outermost electrons, and the majority of their complexes contain the elements in this state. The group oxidation state is never achieved after Group 8 (Fe, Ru, and Os). This limit on the maximum oxidation state correlates with the increase in ionization energy and hence noble character from left to right across each series in the d block. The trend in thermodynamic stability of the group oxidation states of the 3d-series elements is illustrated in Fig. 19.3, which shows the Frost diagram for species in aqueous acidic solution. We see that the group oxidation states of Sc, Ti, and V fall in the lower part of the diagram. This location indicates that the element and any species in intermediate oxidation states are readily oxidized to the group oxidation state. By contrast, species in the group oxidation state for Cr and Mn (+6 and+7, respectively) lie in the upper part of the diagram. This location indicates that they are very susceptible to reduction. The Frost diagram shows that the group oxidation state is not achieved in Groups 8-12 of the 3d series (Fe, Co, Ni, Cu, and Zn), and also shows the oxidation states that are most stable under acid conditions; namely Ti3+, V3+, Cr3+, Mn2+, Fe2+, Co2+, and Ni2+.
The binary compounds of the 3d-series elements with the halogens and with oxygen also illustrate the trend in stabilities of the group oxidation states. The earliest metals can achieve their group oxidation states in compounds with chlorine (for example, ScCl3 and TiCl4), but the more strongly oxidizing halogen fluorine is necessary to achieve the group oxidation state of V (Group 5) and Cr (Group 6), which form VF5 and CrF6, respectively. Beyond Group 6 in the 3d series, even fluorine cannot produce the group oxidation state, and MnF7 and FeF8 have not been prepared. Oxygen brings out the group oxidation state for many elements more readily than does fluorine because fewer O atoms than F atoms are needed to achieve the same oxidation number, thus decreasing steric crowding. For example, the group oxidation state of +7 for Mn is achieved in manganate (VII) salts, such as potassium permanganate, KMnO4. As can be inferred from the Frost diagram in Fig. 19.3, chromate (VI) CrO4-2, manganate (VII) MnO4, and ferrate (VI) FeO4-2 are strong oxidizing agents and become stronger from CrO4 2 to FeO4-2. This trend is another illustration of the decreasing stability of the maximum attainable oxidation state for Groups 6, 7, and 8. Yet another example of the greater difficulty of oxidizing an element to the right of Cr to its group oxidation state is that the air oxidation of MnO2 in molten potassium hydroxide does not take Mn to its group oxidation state but instead yields the deep green compound potassium manganate (VI), K2MnO4 . The disproportionation of MnO4-2 in acidic aqueous solution yields manganese (IV) oxide (MnO2) and the deep purple manganate (VII) ion MnO4:
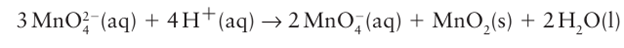
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















