

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Enthalpies of atomization
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
ص260-261
2025-09-03
44
Enthalpies of atomization
Key point: The enthalpy of atomization increases with increasing number of valence electrons. The enthalpy of atomization of an element, ∆aHO, is a measure of the energy required to form gaseous atoms. For solids, the enthalpy of atomization is the enthalpy change
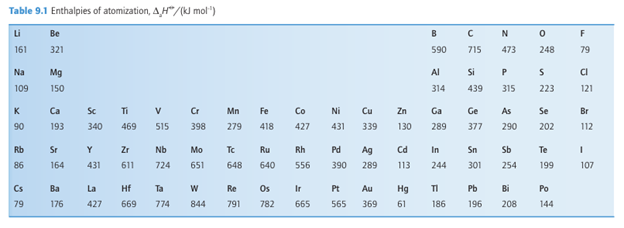
associated with the atomization of the solid; for molecular species, it is the enthalpy of dissociation of the molecules. As can be seen in Table 9.1, enthalpies of atomization first increase and then decrease across Periods 2 and 3, reaching a maximum at C in Period 2 and Si in Period 3. The values decrease between C and N, and Si and P: even though N and P each have five valence electrons, two of these electrons form a lone pair and only three are involved in bonding. A similar effect is seen between N and O, where O has six valence electrons of which four form lone pairs and only two are involved in bonding. These trends are shown in Fig. 9.7. The enthalpies of atomization of the d-block elements are higher than those of the s- and p-block elements, in line with their greater number of valence electrons and consequently stronger bonding. The values reach a maximum at Groups 5 and 6 (Fig. 9.8), where there is a maximum number of unpaired electrons available to form bonds. The middle of each row shows an irregularity due to spin correlation (Section 1.7a), which favours a half filled d shell for the free atom. This effect is particularly evident for the 3d series, in which Cr (3d54s1) and Mn (3d54s2) have significantly lower atomization energies than expected from a simple consideration of their number of valence electrons. The enthalpy of atomization decreases down a group in the s and p blocks but increases down a group in the d block. Thus s and p orbitals become less effective at forming bonds as the period number increases, whereas d orbitals become more effective. These trends are attributed to the expansion of p orbitals on descending a group from optimal for overlap to too diffuse for extensive overlap and, in contrast, d orbitals expanding in size from too contracted to optimal for overlap. The same trends can be seen in the melting points (Table 9.2) of the elements, where a greater number of valence electrons leads to greater binding energy and a higher melting temperature.
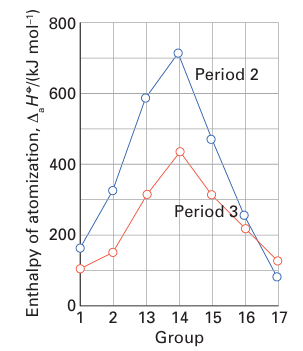
Figure 9.7 Variation of the enthalpy of atomization in the s- and p-block elements.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















