

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Electronegativity
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
ص259-260
2025-09-03
43
Electronegativity
Key points: Electronegativity increases across a period and decreases down a group.We saw in Section 1.9 that the electronegativity, X, is the power of an atom of the element to attract electrons to itself when it is part of a compound. As we saw in Section 1.9b, trends in electronegativity can be correlated with trends in atomic radii. This correlation is most readily understood in terms of the Mulliken definition of electronegativity as the mean of the ionization energy and electron affinity of an element. If an atom has a high ionization energy (so it is unlikely to give up electrons) and a high electron affinity (so there are energetic advantages in its gaining electrons), then it is more likely to attract an electron to itself. Consequently, the electronegativities of the elements, tracking the trends in ionization energies and electron affinities, which in turn track atomic radii, typically increase left to right across a period and decrease down a group. However, the Pauling values of electronegativity are commonly used (Fig. 9.5). There are some exceptions to this general trend as can be seen from the following electronegativities:

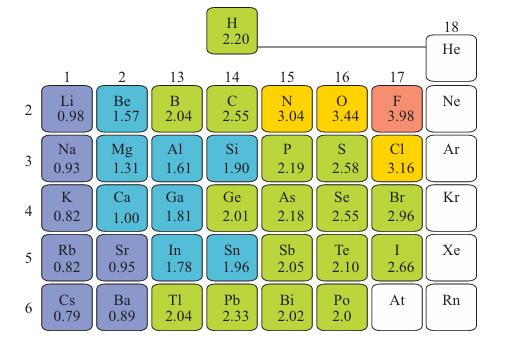
Figure 9.5 The variation of Pauling electronegativity through the main groups of the periodic table.
This departure from a smooth decrease down the group is called the alternation effect and is due to the intervention of the 3d subshell earlier in Period 4. The alternation effect also appears in a more chemically direct manner, where it summarizes (but does not explain) the nonexistence of various compounds in Groups 13 to 15, as in the following examples from Group 15, where the grey denotes unknown compounds (AsCl5 is unstable above -50°C):
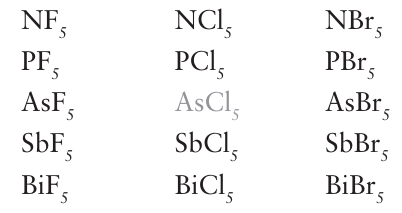
Although electronic factors such as electronegativity no doubt play a role in these examples, steric effects are important too, especially for N. The term ‘electropositive’, which describes an element’s ability to lose electrons, needs to be used with caution. In some applications it means that the element has a low electro- negativity; in others it means that the redox couple Mn /M has a strongly negative standard potential (so that M is a reducing metal). We use the term only in the latter sense in this book.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















