

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Ionization energies and electron affinities
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
ص258-259
2025-09-03
49
Ionization energies and electron affinities
Key point: Ionization energy increases across a period and decreases down a group. Electron affinities are highest for elements near fluorine, particularly the halogens. We need to be aware of the energies needed to form cations and anions of the elements. Ionization energies are relevant to the formation of cations; electron affinities are relevant to the formation of anions. The ionization energy of an element is the energy required to remove an electron from a gas-phase atom (Section 1.9). Ionization energies correlate strongly with atomic radii, and elements that have small atomic radii generally have high ionization energies. Therefore, as the atomic radius increases down a group, the ionization energy decreases. Likewise, the decrease in radius across a period is accompanied by an increase in ionization energy (Fig. 9.2). As discussed in Section 1.9, there are variations in this trend: in particular, high ionization energies occur when electrons are removed from half-filled or full shells or sub shells. Thus the first ionization energy of nitrogen ([He]2s22p3) is 1402 kJ mol-1, which is higher than the value for oxygen ([He]2s22p4, 1314 kJ mol-1). Similarly, the ionization energy of phosphorus (1011 kJ mol 1) is higher than that of sulfur (1000 kJ mol-1). The energies of electrons in hydrogenic atoms are proportional to Z2/n2. A first approximation to the energies of electrons in many-electron atoms is that they are proportional to Zeff2/n2, where Zeff is the effective nuclear charge (Section 1.6), although this proportional ity should not be taken too seriously. Plots of first ionization energies against Zeff2/n2 for the outermost electrons for the elements Li to Ne (n = 2) and Hf to Hg (n = 6) are shown
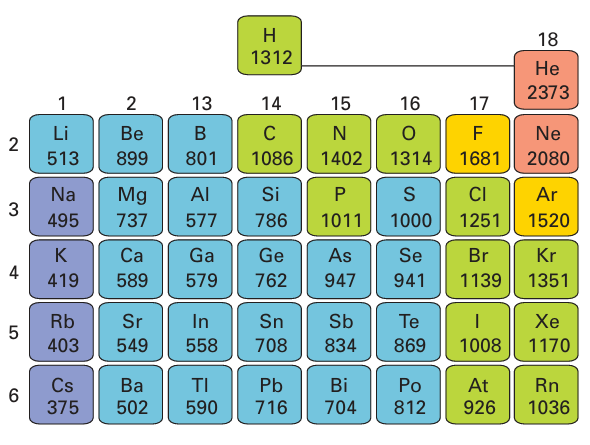
Figure 9.2 The variation of first ionization energy (in kilojoules per mole) through the main groups of the periodic table.
in Figs 9.3 and 9.4, respectively. The graphs confirm that the proportionality is broadly followed, especially at high values of n when the outermost electron experiences an inter action with an almost point-like core. The electron affinity plays a role in assessing the energy required to form an anion. As we saw in Section 1.9c, an element has a high electron affinity if the additional electron can enter a shell where it experiences a strong effective nuclear charge. Therefore, elements close to F (other than the noble gases) have the highest electron affinities as Zeff is then large. The addition of an electron to a singly charged ion (as in the formation of O-2 from O-) is invariably negative (that is, the process is endothermic) because it takes energy to push an electron on to a negatively charged species. However, that does not mean it cannot happen, for it is important to assess the overall consequences of ion formation, and it is often the case that the interaction between highly charged ions in the solid overcomes the additional energy needed to form them. When assessing the energetics of compound formation, it is essential to think globally and not to rule out an overall process simply because an individual step is endothermic.
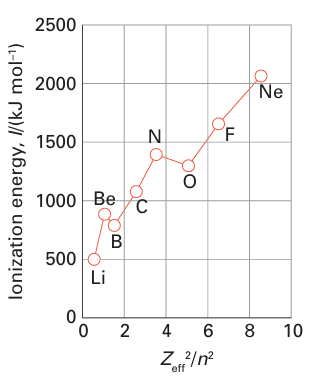
Figure 9.3 Plot of first ionization energies against Zeff2/n2 for the outermost electrons for the elements lithium to neon (n = 2).
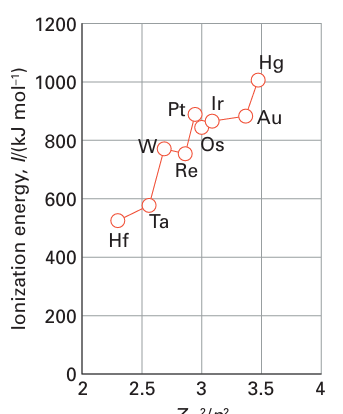
Figure 9.4 Plot of first ionization energies against Zeff2/n2 for the outermost electrons for the elements hafnium to mercury (n = 6).
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















