

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
العملیات الحسابیة في التحلیل الكمي الحجمي:
المؤلف:
م.مسعود فرج ابو ستة
المصدر:
تجارب في الكيمياء التحليلية (التحليل الكمي الحجمي والوزني )
الجزء والصفحة:
4-1-2016
11075
العملیات الحسابیة في التحلیل الكمي الحجمي:
طرق التعبیر عن التركیز:
تعتمد طرق التعبیر عن التركیز علي وحدات فیزیائیة (كالجرام ومشتقاته أوالمللي لترومشتقاته) و علي وحدات كیمیائیة (كالمول ومشتقاته أو المكافئ ومشتقاته) ، لذا یمكن التعبیرعن التركیز في التحلیل الكمي الحجمي بالعدید من الوحدات مثل العیاریة ، المولاریة،التركیز بالجرام لكل لتر والجزء في الملیون (مللي جرام لكل لتر) والجزء في البلیون(میكروجرام لكل مللي) والنسبة المئویة ، ویمكن أن نعتبر هذه الوحداته هي الوحدات الأساسیة في التحلیل الكمي الحجمي التي یعبر بها عن التراكیز في حسابات التحلیل الكمي الحجمي أي
حساب كمیة المواد في العینة المدروسة
Normality 1 العیاریة
ووحدتها (مكافئ/لتر، مللیمكافئ/مللتر) وهي عدد المكافئات الجرامیة من المادة المذابة N ویرمز لها بالرمز في واحد لتر من المحلول، وتستخدم العلاقة التالیة لحساب عیاریة محلول أى مادة كیمیائیة أذا علمت حجم المذیب ووزن المذاب (وزن المادة).
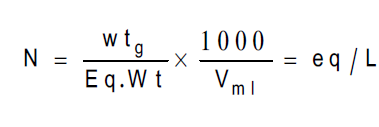
وزن المذاب أو (وزن المادة المذابة) Wt الوزن المكافئ للمذاب (الوزن المكافئ للمادة المذابة) Eq.Wt
حجم المحلول V
اما بالنسبة للعلاقة التالیة فتستخدم لحساب عیاریة المحالیل المركزة (محالیل الاحماض والقواعدالمركزة)
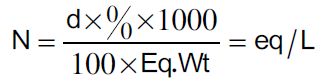
حیث:
(Density) الكثافة d و % النسبة المئویة
الوزن المكافئ للحمض اوالقاعدة المركزة Eq.Wt

أن میزة التعبیر عن التركیز بوحدة العیاریة والكمیات بالمكافئات هو إمكانية تفاعل مكافئ واحد من المادة A مع مكافئ واحد من المادة B تحت أي ظروف ، فمثلاً عند تفاعل (HCl) ) مع (NaOH) نجد إن 1مكافئ (NaOH) سوف تتفاعل مع 1مكافئ من (HCl) أي یتم التفاعل بنسبة (مكافئ:مكافئ) ،فعند أستخدام التراكیز العیاریة في الحسابات الحجمیة الكمیة لتقدیركمیة المواد المحللة ، فإن التفاعل یتم بنسبة مكافئ واحد من المادة Aمع مكافئ واحد من المادة B لذلك فإن التفاعل سیتضمن دائماً عدداً متساویاً من المكافئات حتى في حالة وجود أحد المواد المتفاعلة بكمیة زائدةعن المادة آلاخرى

وعلیه نجد دائماً عند استخدام التركیز العیاري أن:
عدد مكافئات المادة = B عدد مكافئات المادة A


 الاكثر قراءة في التحليل النوعي والكمي
الاكثر قراءة في التحليل النوعي والكمي
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















