

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
التجربة ( 5 )
المؤلف:
م.مسعود فرج ابو ستة
المصدر:
تجارب في الكيمياء التحليلية (التحليل الكمي الحجمي والوزني )
الجزء والصفحة:
4-1-2016
2172
التجربة ( 5 )
معایرة الأحماض متعددة البروتون (متعددة القاعدیة) تعیین عیاریة محلول من حمض الفوسفوریك عند معایرته مع محلول قیاسي من هیدروكسید الصودیوم أو البوتاسیوم.
معادلة التفاعل3NaOH + H3PO4 → Na3PO4 + 3H2O .
الهدف من التجربة :
تعیین عیاریة حمض الفوسفوریك حمض ضعیف ومتعدد القاعدیة وتوضیح هذا النوع من المعایرات كیف تتم وتوضیح الفرق بینها وبین الأحماض القویة المتعددة البروتون أو متعددة القاعدیة والأحماض أحادیة البروتون .
المواد والأدوات المطلوبة :
محلول حمض الفوسفوریك مجهول التركیز .
المواد والأدوات المطلوبة :
محلول حمض الفوسفوریك مجهول التركیز .
محلول قیاسي من هیدروكسید الصودیوم یحضر هذا المحلول بأذابة 3.00 ×10-5 كجم في كل 0.005 لتر ماء مقطر
دلیل الفینول نفثالین ودلیل المیثیل البرتقالي .
السحاحة ماصة سعة 20 مل دورق مخروطي دورق قیاسي سعة 500 مل كأس سعة 400 مل ساق زجاجیة.
خطوات التجربة:
نضف أدوات التجربة جیداً بالماء المقطر، ثم إملاء السحاحة بمحلول هیدروكسید الصودیوم القیاسي وأضبط المحلول على تدریج الصفر ، وتأكد من عدم وجود فقاعات هوائیة في السحاحة والتأكد أیضاً من أن الجزء السفلي للسحاحة ممتلىء بالمحلول .
بأستخدام الماصة خذ 20 مل من محلول حمض الفوسفوریك المجهول التركیز في دورق مخروطي ، ثم أضف إلى الدورق قطرتیبن من دلیل الفینول نفثالین .
أبدا عملیة المعایر بتنقیط محلول هیدروكسید الصودیوم من السحاحة قطرة قطرة مع الرج المستمر، واستمر في عملیة المعایرة حتى یتغیر لون المحلول في دورق المعایرة من عدیم اللون إلى اللون الأحمر أي حتىالوصول إلى نقطة التكافؤ الأولى سجل الحجم المستهلك من السحاحة (حجم هیدروكسید الصودیوم القیاسي) ولیكن V1
كرر نفس الخطوات السابقة ولكن استخدم دلیل المیثیل البرتقالي بدلاً من الفینول نفثالین وعایر حتى الوصول إلى نقطة النهایة(نقطة التكافؤ الثانیة) وسجل الحجم المستهلك من السحاحة ولیكن V2
الحسابات:
الخطوة الاولي في عملیة الحسابات هي معرفة تركیز المحلول القياسي المستخدم في المعایرة
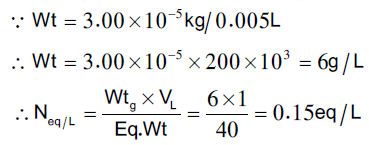
عند استخدام دلیل الفینول نفثالین نجد أن حجم هیدروكسید الصودیوم المستهلك من السحاحة یكافئ ثلثي الحجم الكلي اللازم لمعادلة كل الحمض في العینة المجهولة والمعادلة التالیة توضح هذا الخطوة.
2NaOH+H3PO4→ Na2HPO4 + 2H2O

مما سبق نلاحظ أنه یمكن استخدام أي من الدلیلین في هذه المعایرة ویتم حساب العیاریة حسب كل دلیل كما هو موضح سابقاً في فقرة الحساباتعیاریة حمض الفوسفوریك في حالة استخدام دلیل الفینول نفثالین:

 الاكثر قراءة في التحليل النوعي والكمي
الاكثر قراءة في التحليل النوعي والكمي
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















