


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2024-01-31
التاريخ: 31-1-2017
التاريخ: 31-1-2017
التاريخ: 2023-09-17
|
عن تعرف نقطة تكافؤ المعايرة أنها النقطة التي يضاف فيها حجم من محلول المعايرة علي حجم معين من محلول المادة التي يراد معايرتها بشرط أن يحتوي حجم محلول المعايرة على كمية منه تكافئ كيميائياً المادة المراد معايرتها أي : أنها النقطة التــي يكون فيها :
عدد الملليمكافئات المحلول المعايرة = عدد الملليمكافئات للمادة المراد معايرتها :
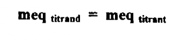
ويتطلب اكتشاف نقطة التكافؤ حدوث تبدل فيزيائي ملحوظ بصورة جيدة يشعرنا بالوصول إلى هذه النقطة أو قريباً جداً منها . وعامة فإن هذا التبدل الفيزيائي هو تبدل حاد في لون مادة - صبغة تعرف بالدليل Indicator تضاف إلي محلول المادة المراد معايرتها بكمية قليلة قبل بدء المعايرة في إثنائه أو قبل نهايته بقليل ومن الواضح أن الدليل يجب أن ينتقي بعناية بشرط أن يعطي تبدلاً حاداً في اللون عند نقطة التكافؤ أو قريباً جداً منها فيكون الخطأ مهملاً أو صغيراً جداً بقدر الإمكان . وتسمي النقطة بنقطة الانتهاء End point·
ويسمى أي فرق بين الحجم المطلوب للوصول إلى نقطة التكافؤ والحجم المطلـ للوصول إلى نقطة الانتهاء (أي حدوث تبدل اللون ) بالخطأ العياري أو خطا نقطة الانتهاء . وكلما كان هذا الفرق صغيراً جداً أي : كلما كان الخطأ صغيراً جداً كلما كان الدليل المستعمل أفضل
وهناك الكثير من المعيارات يستخدم بدلاً من الدليل العياني اللوني جهاز يقوم بقياس أو اكتشاف عدد من التغييرات الفيزيائية التي تدل علي نقطة التكافؤ . ومـن هـذه الصفات العزق في الجهد بين قطبين مغموسين في المحلول والتوصيلة الكهربائية للمحلول ومعامل الانكسار أو درجة الحرارة وكمية امتصاص الضوء الـمـار خــلال المحلول...... وغيرها من الخواص الكهربائية والضوئية والفيزيائية الأخرى .
ولابد أن يكون الدليل المختار قادراً علي أن يعاني تبدلاً عكسياً بما يسمح إجراء المعايرة بأي من المتفاعلين ، ونعني : عند جعل أي منها محلولاً للمعايرة .
ويمكن الكشف عن نقطة التكافؤ لكل نوع من التفاعل الكيميائي الذي يحدث في إثنائه المعايرة يمكن الكشف عنها بعدة طرق وأحياناً بعدة أنواع مختلفة من تفاعلات الدلائل . وسنوضحها باختصار فيما يأتي :
أولاً : الكشف عن نقطة التكافؤ للمعايرات الترسيبية :-
مع أن عملية الترسيب تستعمل لأغراض الفصل والتحليل الكمي الوزني فأنـه توجد طرق حجمية كثيرة تعتمد علي التفاعلات الترسيبية . ولتقدير نقطة انتهاء التفاعل تستعمل عدة أنواع من الدلائل في المعايرات الترسيبية منها :
أ - تكوين راسب ملون :
يمكن تمثيل ذلك بطريقة " مور " التقدير الكلوريد Mohr's Method حيث تجري المعايرة في محيط متعادل مع استعمال دليل ملون نموذجي - كرومات البوتاسيوم يسحح محلول الكلوريد الذي أضيفت إليه بضع قطرات من أيونات الكرومات بواسطة محلول نترات الفضة AgNO3 . ويمثل تفاعل المعايرة بما يأتي :
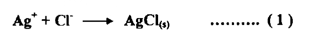
أما المركبان اللذان يترسبان منهما كلوريد الفضة وكرومات الفضة ..... الذي حاصل إذابته -1012 × 1.7 مثال ذلك معايرة محلولين تركيز كل منهما 0.1N لكلوريد الصوديوم ونترات الفضة بوجود ملليمترات قليلة من محلول كرومات البوتاسيوم المخفف ولأن كلوريد الفضة هو الأقل ذوباناً - حاصل الإذابة -10 10 × 1.2 إلى جانب ذلك فإن تركيز أيون الكلوريد في البداية يكون عاليا . فإن كلوريد الفضة سيترسب أولاً.
وتفاعل الدليل مع كمية قليلة زائدة من أيون الفضة وأيون الكرومات كما في التفاعل :
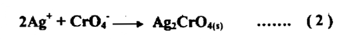
سيؤدي إلى ظهور راسب أحمر من كرومات الفضة يدل على الوصول إلي نقطة الانتهاء واجتيازها بقليل . وعند بدء ترسيب كرومات الفضة يكون مركباً الكلوريد في (1) والكرومات في (2) في حالة اتزان كما يأتي :

ولكي ترسب كرومات الفضة فإن تركيز أيونات الكرومات لابد أن يساوي
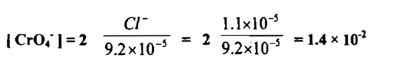
وعملية المعايرة يجب أن تتم في محلول متعادل أو ضعيف القاعدية المحلول يتراوح بين
6 - 10 يعمل دليل التفاعل - الكرومات في هذا المحيط فقط ؛ لأن pH المحلول إن كان أقل من 6 فإن تركيز أيون الهيدروجين يكون عاليا لدرجة تكفي لاختزال تركيز أيونات الكرومات حسب المعايرة التالية :
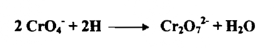
أي أن أيون الفضة لا يترسب حتي لا يكون راسباً مع أيون ثنائي الكرومات . وبهذا يتسبب اختزال تركيز أيون الكرومات في زيادة خطأ نقطة النهاية وفي وسط له pH قيمتها 10 أو أكثر يتفاعل أيون الفضة كما يلي :
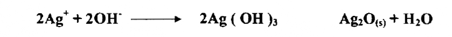
إن تكون راسب (Ag(OH الأسود يميل إلى اختفاء اللون الأحمر لراسب Ag CrO4 عن أنه يسحب Ag من محلول المعايرة مما يسبب خطأ بيناً في حجم محلول المعايرة الحقيقي المطلوب للتفاعل مع الكلوريد . كما أن وجود أي أيون يتفاعل مع Ag سوف يتداخل . ولذا يجب أن تكون هذه الأيونات غير موجودة في المحلول المراد معايرته ومن هذه الأيونات غير موجودة في المحلول المراد معايرته . ومن هذه الأيونات -3 6(S-2, SCN- , I -, Br-, Fe(CN
1- دليل المعقد الملون :
يستخدم دليل المعقد الملون عند معايرة الفضة بطريقة فولهارد Volhard إذ تعاير أيونات الفضة بوجود حامض النتريك المخفف مع محلول معروف التركيز من ثيوسيانات البوتاسيوم KSCN أو ثيوسيانات الأمونيوم NH SCN وفي هذه الحالة يستعمل أيون الحديديك دليلاً ويكون تفاعل المعايرة هو الآتي
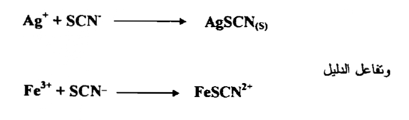
ولقد وجد أن أيون معقد FeSCN2 يكون أحمر اللون أو برتقاليا في المحاليل المخففة . ويضمن نجاح هذا التفاعل فقط في محلول له pH منخفضة فأن كان تركيز أيون الهيدروجين أقل من -3 10× 1 مول فإن أيون الحديديك +3Fe سيتفاعل. ويترسب علي شكل هيدروكسيد الحديديك كما بالمعادلة التالية :
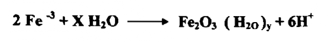
ويمكن منع هذا التفاعل وذلك بأن يكون المحلول حامضياً بقيمة pH مساوية إلي 3 أو أقل . وباستعمال حامض النتريك يجب الانتباه إلى عدم إضافة كمية كبيرة منه لأن SCN سيتأكسد إلي كبريت ونواتج أخرى .
2- الدلائل الامتزازية
هذه الدلائل تتميز بكونها مركبات عضوية ذات جزيئات معقدة تعاني تبدلاً فـ لونها بوصفها نتيجة تغير بنائي طفيف يحدث عندما تمتص هذه الجزيئات علي سطح الراسب ذي الدقائق الغروية . ولأن الدلائل هي أحماض أو قواعد ضعيفة تتأين لتعطي إما أيونات دليل سالبة وأيون الهيدروجين أو أيونات دليل موجبة وأيونات الهيدروكسيل ، فان أيونات الدليل تنفر من الدقائق الغروية للراسب إذا كانت تحمل نفس شحنتها وتنجذب إليها وتمتز على سطحها إذا كانت لها شحنة معاكسة وهذه الدلائل إما أن تكون أصباغاً حامضية مثل دليل ثنائي كلورفلوريســــين Dichloroflouroescein التي تستعمل دليل إمتزاز في معايرة أيـــون الكلوريــــد بواسطة نترات الفضة وتسمي الطريقة معايرة فاجان Fajan's titration وتسمي الدلائل من هذا النوع بالدلائل الامتزازية أو الأدمصاصية . ودليل ثنائي كلور فلوريسين.
حامض ضعيف يعطي في المحلول لوناً أصفر _ مخضراً هو لون أيونـــات ثــــائي كلورفلورسين وأيونات الهيدروجين فإذا ما مثلنا الحامض - ثنائي كلورفلوريسين – الضعيف بـ HDf فإن تفككه يكون كما بالمعادلة التالية :
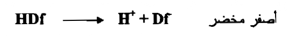
عند معايرة بعض الأيونات السالبة مثل CI بايون موجب مثل +Ag فإن دقائق الراسب المتكون AgCl التي تكون ذات حجوم غروية تمتز بقوة من المحلول . فعند بدء المعايرة تكون أيونات الكلوريد هي الغالبة في المحلول الراسب المتكون ، ، لأن أيونات الكلوريد لم تتفاعل بعد . ولهذا فإن تركيزها أكثر من أيونات الفضة ، ولذلك تمتز أيونات الكلوريد لم تتفاعل بعد . ولهذا فإن تركيزها أكثر من ايونات الفضة ، ولذلك تمتز أيونات الكلوريد بقوة علي سطح الراسب من بين جميع الأيونات في المحلول وهذا يجعل دقائق AgCI ذات شحنة سالبة تنفر من أيونات - Df السالبة . وبعد أن يجتاز التفاعل نقطة التكافؤ بقليل جداً فإن أيونات الفضة +Ag عند ذلك تكون هي الغالبة في المحلول ولذلك فإنها تمتز علي سطح الراسب معطية له شحنه موجبة ، ولذا فإن أيونات - Df السالبة الصفراء - المخضرة اللون ستنجذب إلى الراسب وتمتز على سطحه ، لأن قوي الجذب كبيرة لدرجة تسبب تشويهاً قليلاً في - Df فيبدوا لونها أحمر وردياً . ويدل هذا التبدل في اللون علي الوصول إلى نقطة التكافؤ واجتيازها قليلاً .
ولكي ينجح الدليل الامتزازي في أداء عمله فإن من الأفضل أن تبقي دقائق الراسب في الحالة الغروية لأطول مدة ممكنة . وتزاد مادة غروية مثل الديكسترين إلي المحلول المراد معايرته ليساعد علي تقليل معدل نمو البلورات وتكتلها إلى أن يكمل المعايرة . وهذه الدلائل الامتزازية ممتازة لتعاير كميات صغيرة من أيونات العناصر بشرط أن تكون تراكيز الأيونات المتداخلة صغيرة جداً . أما عند معايرة الكميات الكبيرة من الأيونات فإنه يصعب رؤية نقطة النهاية .
3- مقياس فرق الجهد : Potentiometer
عند وجود أقطاب ملائمة يستعمل جهاز فرق الجهد للكشف عن نقطة التكافؤ وبأخطاء نقطة نهاية من الممكن تجاوزها وإهمالها . ويستعمل الجهاز في تعيين نقطة التكافؤ عملياً لكل التفاعلات العيارية ( التعادل - الأكسدة والاختزال ) ، فضلاً عن بعض العيارية الترسيبية . ويستعمل الجهاز في العيارية الترسيبية في حالة معايرة محلول يحتوي علي الكلوريد مثلاً مع قياس نترات الفضة وذلك بربط مقياس فــرق الجهد إلى قطب الفضة Silver electrode قطب زجاجي مرجع glass reference electrode ثم الأقطاب في محلول الكلوريد ويقرأ فرق الجهــد بــين القطبين ثم تبدأ بإضافة أجزاء من محلول AgNO3 وتقرأ الفولتية وحجم المحلول المضاف في كل مرة بعد الإضافة إلي أن تنتهي العيارية . ترسم قيم الفولتيه مقابل الحجم المضاف في كل مرة وتستخرج النقطة ذات الميل الأعظم greater slope على المنحني فتكون هي نقطة التكافؤ.
وهناك طرق قليلة الاستعمال عملياً ومنها : طرق التعكير التي يتخذ ظهـور التعكير فيها أحياناً دليلاً لانتهاء التفاعل كما في معايرة السيانيد مع محاليل الفضة إذ يتكون المعقد غير الذائب لمركب سيانيد الفضة الفضي ] 2 (Ag[Ag(CN . فضلاً عن طريقة توقف الراسب وطريقة النقطة الواضحة .


|
|
|
|
اكتشاف تأثير صحي مزدوج لتلوث الهواء على البالغين في منتصف العمر
|
|
|
|
|
|
|
زهور برية شائعة لتر ميم الأعصاب التالفة
|
|
|
|
|
|
جمعيّة العميد وقسم الشؤون الفكريّة تدعوان الباحثين للمشاركة في الملتقى العلمي الوطني الأوّل
|
|
|
|
الأمين العام المساعد لجامعة الدول العربية السابق: جناح جمعية العميد في معرض تونس ثمين بإصداراته
|
|
|
|
المجمع العلمي يستأنف فعاليات محفل منابر النور في واسط
|
|
|
|
برعاية العتبة العباسيّة المقدّسة فرقة العبّاس (عليه السلام) تُقيم معرضًا يوثّق انتصاراتها في قرية البشير بمحافظة كركوك
|