

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تحضير المحاليل القياسية الأولية
المؤلف:
م.مسعود فرج ابو ستة
المصدر:
تجارب في الكيمياء التحليلية (التحليل الكمي الحجمي والوزني )
الجزء والصفحة:
ص 46
25-1-2016
26485
تحضير المحاليل القياسية الأولية
والمحاليل القياسية الأولية هي محاليل المواد القياسية الأولية معلوم التركيز العياري أو المولاري . وتحضير بإذابة وزن معلوم من المادة القياسية في حجم معلوم من المحلول أو من المذيب ويتم حساب هذا الوزن باستخدام العلاقة التالية
الوزن المكافئ ( جم/لتر )× (مكافئ/لتر ) العيارية × والوزن بالجرام = الحجم
Wtg = V(L) X N(eq / L) X Eq.Wt(g / eq)
حيث:
Wt الوزن (جم ).
V الحجم المطلوب التحضير فيه باللتر (حجم الدورق القياسي)
N العيارية (مكافئ/ لتر)
Eq. Wt الوزن المكافئ الجرامي للمادة (جم/ مكافئ)
وتطبق هذه العلاقة عند تحضير محلول قياسي عياري ، أماعند تحضيرمحلول قياسي مولاري نطبق نفس المعادلة مع استبدال الوزن المكافئ بالوزن الجزئي والعيارية بالمولارية وتصبح العلاقة نفس المعادلة مع استبدال الوزن المكافئ بالوزن الجزئي والعيارية بالمولارية وتصبح العلاقة بالشكل التالي:
الوزن الجزئي (جم/ مول× ( المولارية ) مول / لتر) × الوزن بالجرام = الحجم باللتر
Wtg = V(L) X M(mol / L) X Mol.Wt(g /mol)
الوزن (جم) Wt حيث
الحجم باللتر وهو حجم المطلوب التحضير فيه(حجم الدورق القياسي) V
الوزن الجزئي الجرامي للمادة (جم/ مول) MOL.Wt المولارية (مول/ لتر M)
وعموماً يمكن أن تحسب عيارية أو مولارية أي محلول قياسي لأي مادة إذا علمنا وزن المادة بالجرام وحجم
المحلول وذلك باستخدام المعادلات الآتية:
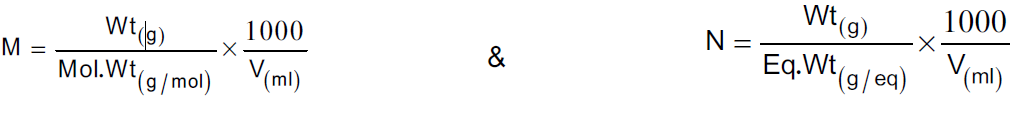
ملاحظة:
يجب أن يتم الوزن باستخدام الموازين الحساسة لأن تحضير المحاليل القياسية يعتمد على دقة الوزن، و بأستخدام هذه المعادلات البسيطة السابقة يمكن تحضير المحاليل القياسية لأي مادة.
المواد القياسية الثانوية:
وهي المواد الكيميائية التي لا تتوفر بها شروط المواد القياسية الولية، فهذه المواد لا تتوفر بصورة نقية وصعبة الوزن وقد تكون مادة متميعة أو مادة متطايرة مثل برمنجانات البوتاسيوم ثاني كرومات البوتاسيوم وتستعمل في معايرات الأكسدة والاختزال هيدروكسيد الصوديوم،هيدروكسيد البوتاسيوم حمض الهيدروكلوريك ، حمض الخليك وهذه المواد تستعمل في معايرات الحموضة والقلوية واليود ، ثيوكبريتات الصوديوم ويستعمل في المعايرات اليودومترية.
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















