

النبات

مواضيع عامة في علم النبات

الجذور - السيقان - الأوراق

النباتات الوعائية واللاوعائية

البذور (مغطاة البذور - عاريات البذور)

الطحالب

النباتات الطبية


الحيوان

مواضيع عامة في علم الحيوان

علم التشريح

التنوع الإحيائي

البايلوجيا الخلوية


الأحياء المجهرية

البكتيريا

الفطريات

الطفيليات

الفايروسات


علم الأمراض

الاورام

الامراض الوراثية

الامراض المناعية

الامراض المدارية

اضطرابات الدورة الدموية

مواضيع عامة في علم الامراض

الحشرات


التقانة الإحيائية

مواضيع عامة في التقانة الإحيائية


التقنية الحيوية المكروبية

التقنية الحيوية والميكروبات

الفعاليات الحيوية

وراثة الاحياء المجهرية

تصنيف الاحياء المجهرية

الاحياء المجهرية في الطبيعة

أيض الاجهاد

التقنية الحيوية والبيئة

التقنية الحيوية والطب

التقنية الحيوية والزراعة

التقنية الحيوية والصناعة

التقنية الحيوية والطاقة

البحار والطحالب الصغيرة

عزل البروتين

هندسة الجينات


التقنية الحياتية النانوية

مفاهيم التقنية الحيوية النانوية

التراكيب النانوية والمجاهر المستخدمة في رؤيتها

تصنيع وتخليق المواد النانوية

تطبيقات التقنية النانوية والحيوية النانوية

الرقائق والمتحسسات الحيوية

المصفوفات المجهرية وحاسوب الدنا

اللقاحات

البيئة والتلوث


علم الأجنة

اعضاء التكاثر وتشكل الاعراس

الاخصاب

التشطر

العصيبة وتشكل الجسيدات

تشكل اللواحق الجنينية

تكون المعيدة وظهور الطبقات الجنينية

مقدمة لعلم الاجنة


الأحياء الجزيئي

مواضيع عامة في الاحياء الجزيئي


علم وظائف الأعضاء


الغدد

مواضيع عامة في الغدد

الغدد الصم و هرموناتها

الجسم تحت السريري

الغدة النخامية

الغدة الكظرية

الغدة التناسلية

الغدة الدرقية والجار الدرقية

الغدة البنكرياسية

الغدة الصنوبرية

مواضيع عامة في علم وظائف الاعضاء

الخلية الحيوانية

الجهاز العصبي

أعضاء الحس

الجهاز العضلي

السوائل الجسمية

الجهاز الدوري والليمف

الجهاز التنفسي

الجهاز الهضمي

الجهاز البولي


المضادات الميكروبية

مواضيع عامة في المضادات الميكروبية

مضادات البكتيريا

مضادات الفطريات

مضادات الطفيليات

مضادات الفايروسات

علم الخلية

الوراثة

الأحياء العامة

المناعة

التحليلات المرضية

الكيمياء الحيوية

مواضيع متنوعة أخرى

الانزيمات
EF-Hand Motif
المؤلف:
N. J. Skelton, J. Kördel, M. Akke, S. Forsén, and W. J. Chazin
المصدر:
Nature Struct. Biol. 1, 239-245
الجزء والصفحة:
28-4-2016
3035
EF-Hand Motif
The majority of calcium-binding proteins involved in intracellular Ca2+ signal transduction are characterized by a common helix–loop–helix structural protein motif in their Ca2+-binding sites that is termed the EF-hand. Well over a thousand EF-hand motif sequences have been identified. An exquisite fine-tuning of the packaging of EF-hands provides these proteins with both high selectivity for Ca2+ and the ability to respond rapidly and efficiently to the modest (100-fold) changes in concentration associated with Ca2+ signals. In fact, the unique relationship between the EF-hand motif and Ca2+ binding extends beyond the ability to transduce Ca2+ signals, as other members of this protein family have critical roles in the uptake, transport and homeostasis of Ca2. +
The term “EF-hand motif” was introduced by Kretsinger on examination of the three-dimensional structure of parvalbumin, the first member of the EF-hand Ca2+-binding protein family whose three-dimensional structure was determined (1). A great deal of structural insight into the variability of the EF-hand motif has been obtained from subsequent X-ray crystallography and NMR solution structure analysis of EF-hand calcium-binding proteins. EF-hand motifs almost always occur in pairs packed together in a face-to-face manner, forming a stable globular domain (Fig. 1). The pairing of sites is presumed to stabilize the protein conformation, increase the Ca2+ affinity of each site over that of isolated sites, and provide a ready means for the cooperativity in the binding of Ca2+ that is critical to their function. The conformations of EF-hands are variable and are dependent on whether ions are bound.

Figure 1. Ribbon diagram of the canonical EF-hand of the N-terminal domain of calmodulin using the coordinates of 1CFC (3).
The canonical EF-hand consists of a 29-residue contiguous segment of polypeptide chain containing an a-helix designated as E in the original parvalbumin structure (residues 1–10), a loop around the calcium ion (residues 10–21), and a second a-helix designated F (residues 19–29). The consensus sequence is shown in Figure 2. Residues 10, 12, 14, 16, 18, and 21 chelate the Ca2+ ion. Residues 10, 12, and 14 provide monodentate oxygen ligands, and residue 21 provides a bidentate oxygen ligand, all via side-chain carboxyl groups. Residue 16 directly coordinates Ca2+ via its main-chain oxygen. Residue 18 ligates Ca2+ indirectly, through a stably bound water molecule. Other residues have been assigned specific roles in stabilizing the EF-hand motif. For example, a central hydrophobic core is formed from the side chains of residues 2, 5, 6, and 9 of helix E; 22, 25, 26, and 29 of helix F; and 17 from the binding loop.
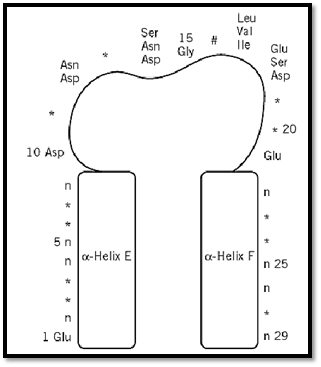
Figure 2. Schematic diagram of the consensus sequence for the EF-hand Ca2+-binding motif. Residues marked with * have no constraints on which amino acids occur there. Residue 16, #, chelates the calcium by its backbone carbonyl oxygen atom. The residues of the E and F helices marked “n” must be nonpolar for packing of the two helices.
Most EF-hand proteins use this canonical motif. The S100 proteins (an important subfamily of Ca2+-binding proteins), however, have a two-residue insertion and a modified coordination scheme in the first binding loop. In these pseudo-EF-hands, residues 10, 13, 15, and 18 chelate the Ca2+ ion via their main-chain carbonyl oxygen atoms, whereas residue 20 chelates indirectly via a water molecule, and acidic residue 23 provides bidentate ligation via its side-chain carboxylate. The role of these pseudo-EF-hands in modulating the structure or function of S100 proteins is still under investigation, although there is evidence that the packaging of a pseudo-EF-hand and a canonical EF-hand attenuates the changes in the structure and dynamics of the protein induced by the binding of calcium (2).
References
1. R. H. Kretsinger and C. E. Nockolds (1973) J. Biol. Chem. 248, 3313–3326.
2. N. J. Skelton, J. Kördel, M. Akke, S. Forsén, and W. J. Chazin (1994) Nature Struct. Biol. 1, 239-245.
3. H. Kuboniwa, N. Tjandra, S. Grzesiek, H. Ren, C. B. Klee, and A. Bax (1995) Nature Struct. Biol. 2, 768–776.
4. N. C. J. Strynadka and M. N. G. James (1989) Crystal structures of the helix-loop-helix calcium-binding proteins, Annu. Rev. Biochem. 58, 951–998.
 الاكثر قراءة في مواضيع عامة في الاحياء الجزيئي
الاكثر قراءة في مواضيع عامة في الاحياء الجزيئي
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















