
Many Types of DNA-Binding Domains Have Been Identified
 المؤلف:
JOCELYN E. KREBS, ELLIOTT S. GOLDSTEIN and STEPHEN T. KILPATRICK
المؤلف:
JOCELYN E. KREBS, ELLIOTT S. GOLDSTEIN and STEPHEN T. KILPATRICK
 المصدر:
LEWIN’S GENES XII
المصدر:
LEWIN’S GENES XII
 الجزء والصفحة:
الجزء والصفحة:
 10-6-2021
10-6-2021
 2973
2973
Many Types of DNA-Binding Domains Have Been Identified
KEY CONCEPTS
- Activators are classified according to the type of DNAbinding domain.
- Members of the same group have sequence variations of a specific motif that confer specificity for individual DNA target sites.
It is common for an activator to have a modular structure in which different domains are responsible for binding to DNA and for activating transcription. Factors are often classified according to the type of DNA-binding domain. In general, a relatively short motif in this domain is responsible for binding to DNA:
- The zinc finger comprises a DNA-binding domain. It was originally recognized in factor TFIIIA, which is required for RNA polymerase III to transcribe 5S rRNA genes. The consensus sequence of a single finger is:
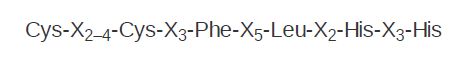
The zinc-finger motif takes its name from the loop of approximately 23 amino acids that protrudes from the zinc-binding site and is described as the Cys2 /His2 finger. The zinc is held in a tetrahedral structure formed by the conserved Cys and His residues. This motif has since been identified in numerous other transcription factors (and presumed transcription factors). Proteins often contain multiple zinc fingers, such as the three shown in FIGURE 1 . Some zinc-finger proteins can bind to RNA.
- Steroid receptors (and some other proteins) have another type of zinc finger that is different from the Cys2/His2 finger. Its structure is based on a sequence with the zinc-binding consensus:
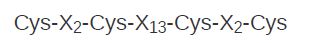
These sequences are called Cys2 /Cys2 fingers. The steroid receptors are defined as a group by a functional relationship: Each receptor is activated by binding a particular steroid, such as glucocorticoid binding to the glucocorticoid receptor. Together with other receptors, such as the thyroid hormone receptor or the retinoic acid receptor, the steroid receptors are members of the superfamily of ligand-activated activators with the same general modus operandi: The protein factor is inactive until it binds a small ligand, as shown in FIGURE 2 . The steroid receptors bind to DNA as dimers—either homodimers or heterodimers. Each monomer of the dimer binds to a half-site that may be palindromic or directly repeated.
The helix-turn-helix motif was originally identified as the DNAbinding domain of phage repressors. The C-terminal α-helix lies in the major groove of DNA and is the recognition helix; the middle α-helix lies at an angle across DNA. The N-terminal arm lies in the minor groove and makes additional contacts. A related form of the motif is present in the homeodomain, a sequence first characterized in several proteins encoded by Homeobox genes involved in developmental regulation in Drosophila, and by the comparable human Hox genes shown in FIGURE 3 . Homeodomain proteins can be activators or repressors.
The amphipathic helix-loop-helix (HLH) motif has been identified in some developmental regulators and in genes coding for eukaryotic DNA-binding proteins. Each amphipathic helix presents a face of hydrophobic residues on one side and charged residues on the other side. The length of the connecting loop varies from 12 to 28 amino acids. The motif enables proteins to dimerize, either homodimers or heterodimers, and a basic region near this motif contacts DNA,
as shown in FIGURE 4. Not all of the HLH proteins contain a DNA-binding domain, but rather rely on their partner for sequence specificity. Partners may change during development to provide additional combinations.
- Leucine zippers consist of an amphipathic α-helix with a leucine residue in every seventh position. The hydrophobic groups, including leucine, face one side while the charged groups face the other side. A leucine-zipper domain in one polypeptide interacts with a leucine-zipper domain in another polypeptide to form a protein dimer. Rules govern which zippers may dimerize. Adjacent to each zipper is another domain containing positively charged residues that is involved in binding to DNA; this is known as the bZIP (basic zipper) structural motif shown in FIGURE 5.
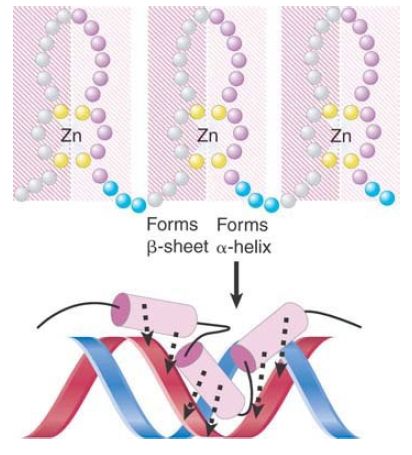
FIGURE 1. Zinc fingers may form α-helices that insert into the major groove, which is associated with β-sheets on the other side.
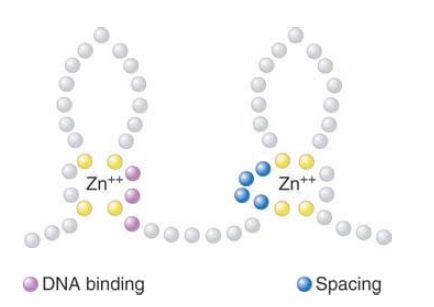
FIGURE 2. The first finger of a steroid receptor controls which DNA sequence is bound (positions shown in purple); the second finger controls spacing between the sequences (positions shown in blue).
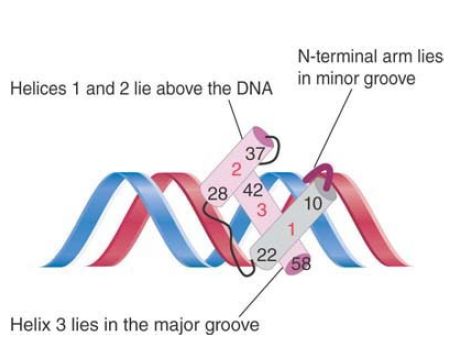
FIGURE 3. Helix 3 of the homeodomain binds in the major groove of DNA, with helices 1 and 2 lying outside the double helix. Helix 3 contacts both the phosphate backbone and specific bases. The N-terminal arm lies in the minor groove and makes additional contacts.
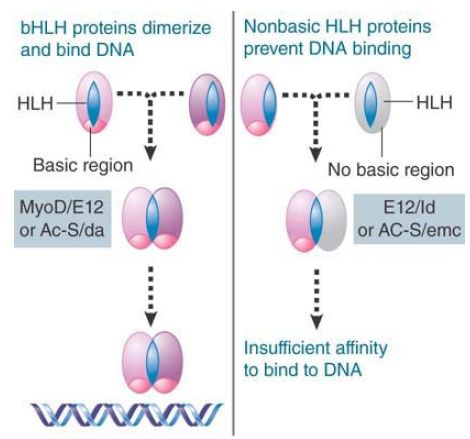
FIGURE 4. A helix-loop-helix (HLH) dimer in which both subunits are of the bHLH type can bind DNA, but a dimer in which one subunit lacks the basic region cannot bind DNA.
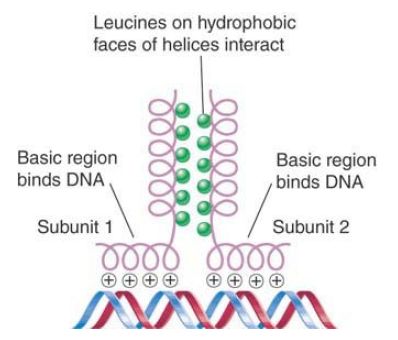
FIGURE 5. The basic regions of the bZIP motif are held together by the dimerization at the adjacent zipper region when the hydrophobic faces of two leucine zippers interact in parallel orientation.
 الاكثر قراءة في مواضيع عامة في الاحياء الجزيئي
الاكثر قراءة في مواضيع عامة في الاحياء الجزيئي
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


