

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الخواص الحامضية - القاعدية للأحماض الأمينية
المؤلف:
د. طارق يونس احمد / د. لؤي عبد علي الهلالي
المصدر:
الكيمياء الحياتية
الجزء والصفحة:
ج 1 ص 113-115
2023-11-12
3122
عند وضع الحامض الأميني في محيط حامضي فسوف يحمل شحنة موجبة، أما إذا وضع في محيط قاعدي فسوف يحمل شحنة سالبة، ويبقى الشكل الأمفوتيري Zwitter ion (ثنائية القطب Dipolar ions) متعادلاً في محيط متعادل (pH) كما في الشكل ( 10-5) الاتي:
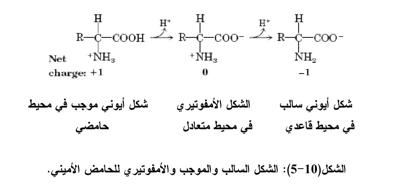
يكون الأيون الأمفوتيري متعادلاً كهربائياً فلا يستطيع الهجرة في المجال الكهربائي، كما يمثــل هـذا التركيب أيضاً الحالة الصلبة للأحماض الأمينية اذ ان ارتفاع درجات الانصهار Melting points لجميـــع الأحماض الأمينية فوق 200 م يعزى الى تركيبها الأيوني الذي يحتاج الى طاقة عالية لتفكيك القوى الأيونية للشبكة البلورية للحامض. وأن شكل الأحماض الأمينية موجود غالباً بصورة متأينة في سوائل الجسم الحــ عند الأس الهيدروجيني مقارباً لـ 7 (الشكل الأمفوتيري للأحماض الأمينية)، ولكن يمثل التركيب الكيميائي للحامض الأميني بشكل غير متأين لغرض التأكيد على مجموعتي الأمين والكاربوكسيل.
وبما ان البروتين يتألف من أحماض أمينية، ولهذا فهو مادة أمفويترية وان كل بروتين له نقطة تعادل كهربائي معينة وتدعى الأس الهيدروجيني pH الذي لا ينجذب فيه الأيون الثنائي القطب عند وضـــعـه فــــي مجال كهربائي نحو أي من القطبين بنقطة التعادل (التماثل) الكهربائي (Isoelectric point (pI وله القابلية على معادلة الأحماض والقواعد. وهكذا فأن مثل هذه الخصائص للبروتينات تمكنها من ان تعمل بوصفها مواداً منظمة او حافظة Buffers في الدم او في سوائل الجسم الأخرى.
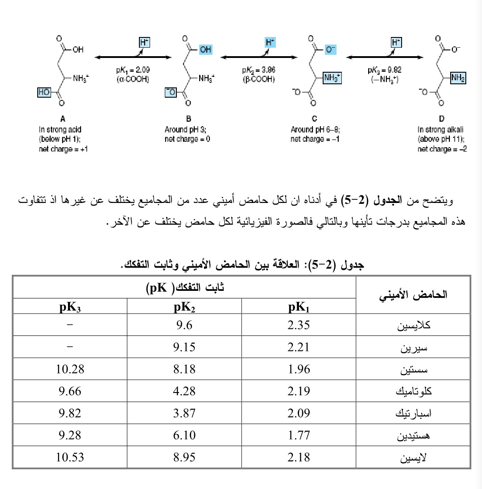
أن الطبيعة الأيونية الثنائية للأحماض الأمينية لها تعطي اثنين من ثوابت التأين على الأقل وذلـك عنـد تفاعلها مع الحامض او القاعدة. ففي المحاليل المنظمة البسيطة فان معادلة الباحثان هندرسن - هسيلببرج تمثل ثابت التأين pK بأنه الـ pH ( الأس الهيدروجيني) التي توجد عندها تراكيز متساوية من الملح والحامض للمحلول المنظم كما في المعادلة الأتية:

ويمكن استعمال حامض أميني بسيط مثل الكلايسين مثالاً للأحماض الأمينية او البروتينات) التي تعمل بوصفها محاليلاً منظمة. فعند معايرة محلول الكلايسين مع حامض أو قاعدة، فإن الحامض الأميني يتغير من شكل الأيون الثنائي القطب الى شكل متأين يحمل فقط مجموعة أمين مشحونة او مجموعة كاربوكسيل مشحونة ، ويمكن تمثيل هذا بالمعادلة الآتية:
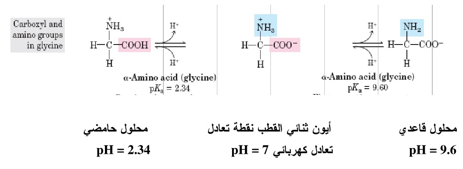
ان للأحماض الكاربوكسيلية أحادية الأمين قيمتين لثابت التأين pK وهي تعمل منظمات في منطقتين من الأس الهيدروجيني كما هو الحال للكلايسين. ويمكن حساب الـ pH لنقطة التعادل الكهربائي وذلك بقسمة مجموع قيمتي pK على 2:

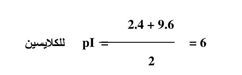
أما الأحماض الأمينية التي تحتوي على مجموعة جانبية متأينة مثل حامض الأسبارتيك واللايسين فلديها ثلاث قيم pK اذ تمثل قيمة pK تأين المجموعة الجانبية للحامض الأميني pK ، وتتواجد كل من هذه الأحماض الأمينية بأربعة إشكال متأينة، ويمكن تمثيل تأين حامض الأسبارتيك كالاتي:















 قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى) قسم الشؤون الفكرية يصدر كتاب (سر الرضا) ضمن سلسلة (نمط الحياة)
قسم الشؤون الفكرية يصدر كتاب (سر الرضا) ضمن سلسلة (نمط الحياة)

















